La evolución no solamente puede producirse deliberadamente mediante la cría selectiva o la selección artificial; también puede darse de forma espontánea en un contexto experimental o en la naturaleza, sin ningún tipo de intervención humana.
Evolución en el laboratorio
Tal y como vimos, la evolución es un proceso que se produce entre generaciones. Por este motivo, cuando el tiempo generacional de una especie es largo (por ejemplo, de años), la evolución es difícil de estudiar en tiempo real. Imaginemos que deseamos estudiar cómo evolucionará el elefante africano, que tiene un tiempo generacional de unos 25 años. En el periodo de vida de una generación de científicos se podrían estudiar, a lo sumo, 3 generaciones de elefantes, las cuales son muy pocas para que se puedan producir cambios evolutivos significativos en su genoma, metabolismo o fisiología.
Ahora bien, esto cambia con las especies que tienen un tiempo generacional bajo, como la mayoría de microorganismos. En condiciones de abundancia de alimento, la bacteria Escherichia coli presenta un tiempo generacional de entre 15 y 20 minutos. Eso significa que a lo largo de un día se producen alrededor de 80 generaciones, mientras que al cabo de un mes unas 2500. Este número de generaciones es ya suficiente para que se puedan producir algunos cambios en los genes y fisiología de los organismos.
Por este motivo, una estrategia que emplean los científicos para investigar la evolución en tiempo real es estudiar poblaciones de bacterias y otros microorganismos en un contexto experimental. Por ejemplo, el biólogo evolutivo de la Universidad Estatal de Michigan Richard Lenski dirige un estudio de laboratorio sobre la evolución de la bacteria Escherichia coli que alcanzó las 73500 generaciones en el año 2020 (para replicar semejante experimento en elefantes deberíamos esperar casi 2 millones de años), antes de ser suspendido provisionalmente por la pandemia de COVID-19 (Lenski, 9 de marzo de 2020).
Dentro de los estudios de evolución en laboratorio llevados a cabo con microorganismos, son especialmente habituales los experimentos de resistencia a antibióticos. La lógica de estos experimentos es sencilla: se introduce a una población de bacterias en un medio con antibiótico y se determina la tasa de supervivencia y reproducción de los distintos individuos que componen la población. Tal y como veremos en próximos apartados, lo habitual es que dentro de una población existan individuos que porten mutaciones heredables que los hagan más aptos para sobrevivir en un determinado medio. Por ejemplo, en el caso de las bacterias y los antibióticos, es posible que uno o unos pocos individuos porten mutaciones heredables que afecten a ciertas proteínas de su membrana y que los hagan resistentes a los antibióticos. En casos como este, lo esperable de acuerdo a la teoría de la selección natural es que dichos individuos dejen mayor descendencia, y, en consecuencia, que el porcentaje de individuos que porten dicha mutación aumente en la población. Este caso de evolución por selección natural ocurre con mucha frecuencia y es fácilmente estudiable en el laboratorio.
Un ejemplo particularmente ilustrativo de este tipo de evolución de microorganismos en un contexto experimental es el descrito por Baym et al. (2016), publicado en la prestigiosa revista Science en el año 2016. En dicho experimento, los investigadores crearon una placa de Petri de 120 centímetros de largo y 60 de ancho. La placa se cubrió con un medio de cultivo en el que podía crecer Escherichia coli, la bacteria que se usó en el experimento. La placa se dividió en 9 compartimentos que separaban zonas con concentración creciente del antibiótico trimetoprima (capaz de impedir el crecimiento de E. coli), de forma que la concentración iba aumentando desde los extremos hacia el centro (ver Figura 1).
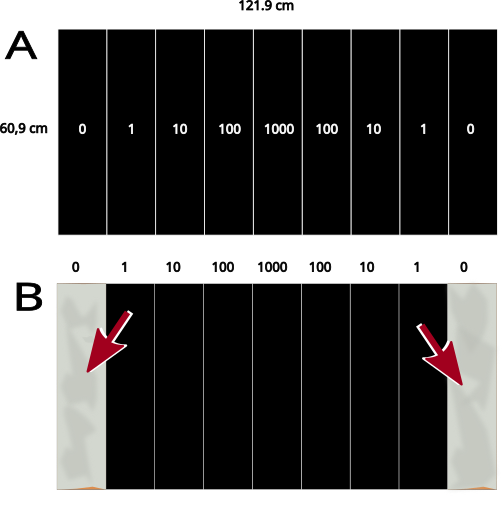
Los investigadores introdujeron muestras de E. coli en los extremos de la placa, y fueron filmando el desarrollo de las mismas. La lógica detrás del experimento es que, a medida que las bacterias se fueran multiplicando, estas irían colonizando las zonas más interiores de la placa, en las cuales la concentración de antibiótico era mayor. Tal y como predijeron los científicos, a medida que el experimento fue desarrollándose, las bacterias fueron ocupando todo el medio comenzando desde los extremos, reproduciéndose y colonizando nuevos compartimentos hasta alcanzar el centro. Sin embargo, cada vez que las bacterias se encontraban con una nueva zona de concentración más alta de antibiótico, su crecimiento se veía retrasado hasta que por azar surgía alguna mutación genética heredable en la población que habilitaba a su portador a seguir creciendo (Figura 2).

Dicho proceso se repitió hasta completar el crecimiento de las bacterias en todas los compartimentos de la mesa (Figura 3). Al finalizar el experimento, los investigadores fueron capaces de identificar de forma exacta en qué gen de las bacterias y en qué nucleótidos del mismo se habían ido produciendo las mutaciones que les confirieron una ventaja durante el crecimiento (Figura 3). Este ejemplo muestra a las claras cómo en ocasiones se pueden observar en tiempo real procesos evolutivos en un contexto de laboratorio.

Evolución en la naturaleza: pinzones de Galápagos
En determinadas circunstancias la evolución también es observable en la naturaleza. Un ejemplo bien descrito de evolución en la naturaleza es el de las distintas especies de pinzón de las islas Galápagos. Los pinzones de Galápagos, junto con otras especies de animales de este archipiélago, fueron ya estudiados por Charles Darwin durante su viaje a bordo del Beagle (1831-1836), y más tarde jugarían un papel importante a la hora de convencerse acerca de la realidad del hecho evolutivo. No obstante, los estudios relevantes de cara a nuestro propósito no son los de Charles Darwin, sino los de los biólogos evolutivos Peter y Rosemary Grant.
En el archipiélago de Galápagos existen múltiples especies de pinzones, cada una de ellas adaptada a un tipo de dieta particular. Por ejemplo, en la isla de Daphne Mayor, en la que los Grant han llevado a cabo sus investigaciones, existen un total de trece especies de pinzones. Estas especies varían en el tamaño de su pico, que va desde el grande y grueso propio del gran pinzón de tierra (Geospiza magnirostris) hasta los de menor tamaño y fuerza, como el del pinzón fuliginoso (Geospiza fuliginosa). Los diferentes tamaños de pico presentes en las distintas especies de pinzones son adaptaciones a los distintos tipos de semillas que constituyen su dieta. Así, los pinzones con picos grandes están adaptados a semillas gruesas y de gran tamaño, mientras que los que presentan picos más pequeños lo están a las semillas de menor tamaño.

En el año 1973, los Grant comenzaron un estudio en la isla de Daphne Mayor con el objetivo de averiguar cómo se producía la formación de nuevas especies empleando como modelo los pinzones de Galápagos. Para ello registraban anualmente la demografía de los pinzones y trataban de averiguar qué factores la determinaban. No obstante, en el año 1977 tuvo lugar un suceso excepcional. Durante la temporada de lluvias de aquel año apenas llovió 24 milímetros por metro cuadrado. Esta sequía provocó que las plantas de las cuales se alimentaban algunas especies de pinzones no produjeran semillas. En particular, las semillas de menor tamaño desaparecieron de una forma prácticamente completa. Este acontecimiento provocó la muerte de un gran número de ejemplares de las especies de pinzones que solían alimentarse de esta clase de semillas.
Especialmente llamativo fue el caso de la especie de pinzón picomediano (Geospiza fortis). Tal y como su nombre indica, el pinzón picomediano posee un pico de un tamaño intermedio en comparación con los de otras especies de pinzón de Galápagos. Este factor le permite acceder a una mayor variedad de semillas, pudiendo alimentarse de semillas de menor y mayor tamaño. Como cualquier otra especie en la naturaleza, los miembros de las poblaciones de pinzón picomediano de Galápagos muestran variedad en lo que se refiere a su fenotipo. En particular, los individuos de esta especie varían en el tamaño de pico que presentan, habiendo algunos ejemplares con un pico más grueso y otros con un pico más fino que el promedio de la especie.
Pues bien, los Grant observaron que el promedio del pico de los supervivientes a la sequía era significativamente mayor que el de la población en el año antes de que esta tuviera lugar (1976) (véase Figura 5). La explicación que dieron los Grant a este cambio en el tamaño del pico es que, dado que las semillas de menor tamaño habían desaparecido con la sequía, los individuos con picos menores, que se alimentaban preferentemente de ellas, perecieron en mayor medida que los individuos con picos mayores, que podían alimentarse también de semillas de menor tamaño. En otras palabras: la sequía había generado una presión selectiva a favor de los individuos con picos mayores, dado que solo estos eran capaces de obtener los recursos disponibles.

Dado que el tamaño de pico es un rasgo heredable, las siguientes generaciones de pinzones picomediano supervivientes a la sequía tendieron a mantener un pico de mayor tamaño. Así pues, la sequía promovió un proceso evolutivo en un corto periodo de tiempo.
Para saber más:
Baym, M., Lieberman, T. D., Kelsic, E. D., Chait, R., Gross, R., Yelin I. & Kishony, R. (2016). Spatiotemporal microbial evolution on antibiotic landscapes. Science, 353(6304): 1147-1151.
HHMI Biointeractive Video (8 de septiembre de 2017). El Origen de las Especies: El Pico del Pinzón.. Youtube. Recuperado el 11/09/20 de: https://www.youtube.com/watch?v=OQ4OdCp59c4
Lenski, R. (9 de marzo de 2020). We Interrupt This Experiment. Telliamed, Revisited. Recuperado el 11/09/20 de: https://telliamedrevisited.wordpress.com/2020/03/09/we-interrupt-this-experiment/
Weiner, J. (1994). The Beak of the Finch: A Story of Evolution in Our Time, New York, NY: Vintage Books.